Ligação metálica
Ligação metálica é a ligação entre metais e metais. Formam as chamadas ligas metálicas, que são cada vez mais importantes para o nosso dia a dia.
No estado sólido, os metais se agrupam de forma geometricamente ordenados, formando as células, ou grades ou retículo cristalino. Uma amostra de metal é constituída por um grande número de células unitárias formadas por cátions desse metal.
Na ligação entre átomos de um elemento metálico, ocorre liberação parcial dos elétrons mais externos, com a consequente formação de cátions, que formam as células unitárias. Esses cátions têm suas cargas estabilizadas pelos elétrons que foram liberados e que ficam envolvendo a estrutura como uma nuvem eletrônica. São dotados de um certo movimento e, por isso, chamados de elétrons livres.
Essa movimentação dos elétrons livres explica por que os metais são bons condutores elétricos e térmicos. A consideração de que a corrente elétrica é um fluxo de elétrons levou à criação da Teoria da Nuvem Eletrônica ou Teoria do “Mar” de elétrons.
Pode-se dizer que o metal seria um aglomerado de átomos neutros e cátions, mergulhados numa nuvem ou "mar" de elétrons livres. Esta nuvem de elétrons funcionaria como a ligação metálica, que mantém os átomos unidos.
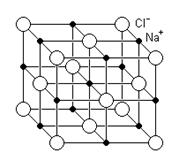
Figura geométrica do NaCl (cloreto de sódio)

Um cristal ou retículo cristalino de NaCl aumentado 300 vezes
São estas ligações e suas estruturas que os metais apresentam uma série de propriedades bem características, como por exemplo o brilho metálico, a condutividade elétrica, o alto ponto de fusão e ebulição, a maleabilidade, a ductilidade, a alta densidade e a resistência à tração.
As ligas metálicas são a união de dois ou mais metais. Às vezes com não-metais e metais. As ligas têm mais aplicação do que os metais puros. Algumas ligas:
- bronze (cobre + estanho) – usado em estátuas, sinos.



- aço inoxidável (ferro + 0,1 de carbono + 18% de cromo + 8% de níquel) - não enferruja (diferente do ferro e do aço comum), é usado em vagões de metrô, fogões, pias e talheres.


- latão (cobre + zinco) – usado em armas e torneiras.


- ouro / em joias (75% de ouro ou prata + 25% de cobre) - usado para fabricação de joias. Utiliza-se 25% de cobre para o ouro 18K. E o ouro 24K é considerado ouro puro.

As substâncias metálicas são representadas graficamente pelo símbolo do elemento:
Exemplo: Fe, Cu, Na, Ag, Au, Ca, Hg, Mg, Cs, Li.































