Soluções
As misturas podem ser homogêneas ou heterogêneas.
As misturas homogêneas possuem uma fase distinta. As misturas heterogêneas possuem duas ou mais fases distintas.
Solução é uma mistura homogênea entre duas ou mais substâncias. O processo utilizado para obter essa mistura é chamado de dissolução.
Uma solução é sempre formada pelo soluto e pelo solvente.
![]()
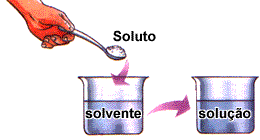
Soluto – substância que será dissolvida.
Solvente – substância que dissolve.
A água é chamada de solvente universal. Isso porque ela dissolve muitas substâncias e está presente em muitas soluções.
As soluções podem ser formadas por qualquer combinação envolvendo os três estados físicos da matéria: sólido, líquido e gasoso.
Exemplos de soluções no nosso dia a dia:
- álcool hidratado
- acetona
- água mineral
- soro fisiológico
Tipos de dispersão
Dispersão – são sistemas nos quais uma substância está disseminada, sob a forma de pequenas partículas, em uma segunda substância.
Um exemplo é a mistura entre água e areia em um copo. No início, a mistura fica turva, mas com o passar do tempo, as partículas maiores vão se depositando no fundo do copo.
Mesmo assim, a água ainda fica turva na parte de cima. A água não ficará totalmente livre de areia.
De acordo com o tamanho das partículas, podemos classificar essas dispersões em solução verdadeira, coloide e suspensão.
Veja a seguir o diâmetro médio das partículas dispersas:
Dispersão |
Diâmetro médio |
Soluções verdadeiras |
Entre 0 e 1nm |
Coloides |
Entre 1 e 1.000nm |
Suspensões |
Acima de 1.000nm |
Obs. 1nm (nanômetro) = 1.10-9m































