Cinética química (continuação)
Teoria das colisões
Os átomos das moléculas dos reagentes estão sempre em movimento, gerando muitas colisões (choques). Parte destas colisões aumentam a velocidade da reação química.
Quanto mais choques com energia e geometria adequada houver, maior a velocidade da reação. Há dois tipos de colisões:
- horizontal – colisão mais lenta
- vertical – colisão mais rápida, colisão efetiva
Veja os dois modelos de colisões para a formação de duas moléculas de HCl:
Colisão horizontal
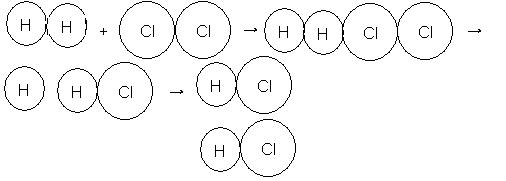
Observe que após a primeira colisão há a formação de apenas uma molécula de HCl. A segunda molécula se formará na segunda colisão.
Colisão vertical
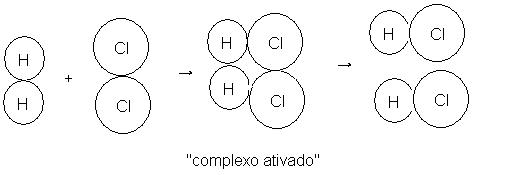
Observe que a molécula de H2 se aproxima da molécula de Cl2 com muita velocidade. Em seguida, se chocam violentamente, formando duas moléculas de HCl que se afastam logo.
A primeira colisão forma o complexo ativado (duas molécuas de HCl). Esta colisão acontece com muita velocidade e portanto mais rápida, mais efetiva. Torna a reação química mais rápida.
O estado intermediário da reação, onde forma-se o complexo ativado é um estado de transição, onde há um alto valor de energia envolvido. O complexo ativado é a espécie química com maior valor energético em toda a reação química que tem vida curtíssima.