Eletrólise
Eletrólise é uma reação não espontânea provocada pelo fornecimento de energia elétrica, proveniente de um gerador (pilhas). É o inverso das pilhas.
A eletrólise possui muitas aplicações na indústria química, na produção de metais, como sódio, magnésio, potássio, alumínio, etc. Também na produção de não metais, como o cloro, o flúor e ainda substâncias como o hidróxido de sódio (soda cáustica) e peróxido de hidrogênio (água oxigenada), e a deposição de finas películas de metais sobre peças metálicas ou plásticas.
Essa técnica de deposição em metais é conhecida como galvanização. As mais comuns são a deposição de cromo (cromagem), níquel (niquelagem), prata (prateação) e ouro (dourar), usados em grades, calotas de carros, emblemas, peças de geladeira, joias e aparelhos de som.
É utilizada também na purificação ou refino eletrolítico de muitos metais, como cobre e chumbo. E em processo de anodização, que nada mais é do que uma oxidação forçada da superfície de um metal para que seja mais resistente à corrosão. É feita a anodização em alumínio.
Na eletrólise, usa-se eletrodos inertes (que não regem), como o carbono grafite (grafita) ou platina. Para que a eletrólise ocorra deve haver:
- corrente elétrica contínua e voltagem suficiente para provocar a eletrólise;
- íons livres ( por fusão ou dissolução)
Existe a eletrólise ígnea e a eletrólise aquosa.
Eletrólise Ígnea
É uma eletrólise onde não há presença de água. Metais iônicos são fundidos (derretidos). Ao se fundirem, eles se ionizam, formando íons. A partir desses íons, é formada a corrente elétrica.
Reação de fusão (transformação do estado físico sólido para líquido) do NaCl a 808°C:
![]()
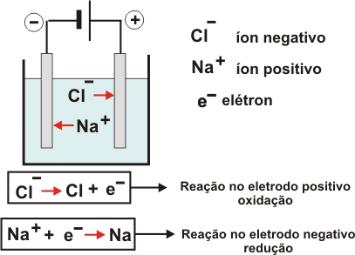
Os eletrodos devem ser inertes. Pode ser carbono grafite ou platina.
Estes eletrodos são polarizados, um com carga negativa e o outro com carga positiva e são colocados em uma cubeta com o metal NaCl já fundido.
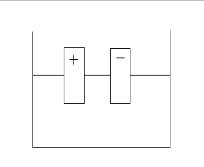
Observe que no desenho há dois eletrodos carregados eletricamente, o polo positivo e o polo negativo, mergulhados em um metal fundido.
A reação acima mostra a formação de íons Na+ e íons Cl-. Quando estes íons entrarem em contato com os eletrodos, o íons positivo (Na+) irá para o eletrodo negativo. O íon negativo (Cl-) irá para o eletrodo positivo.
No eletrodo negativo, haverá formação de sódio metálico (Na°). No eletrodo positivo, formará gás cloro (Cl2). Percebe-se a formação de bolhas.
O eletrodo positvo é chamado de ânodo e nele ocorre a reação de oxidação.
O eletrodo negativo é chamado de cátodo e nele ocorre a reação de redução.
Reações:
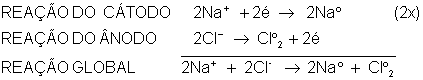
A reação do cátodo deve ser multiplicada por 2 para poder cancelar com a reação do ânodo, já que forma gás cloro (Cl2).
Fonte: alfaconnection.net/pag_avsf/fqm0302.htm