Produto hidrogeniônico (pH)
Sendo KW = [H+] . [OH-] e KW =1.10-14, calcule o valor da concentração de íons H+ e de íons OH-:
![]()
![]()
![]()
![]()
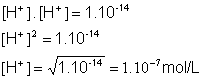
Então se 1.10-7 é a solução neutra, se houver maior quantidade de íons H+, a solução será ácida. Se houver maior quantidade de íons OH-, a solução será básica.
Os químicos inventaram uma maneira mais simplificada para expressar esses valores. Foi utilizado o conceito de pH para calcular a quantidade de íons nestas soluções aquosas.
pH é o produto hidrogeniônico da água e é uma escala criada para medir a acidez de soluções aquosas. pOH mede a quantidade de íon OH- nas soluções aquosas.
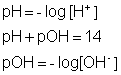
Veja a escala feita com os valores calculados anteriormente:
CONCENTRAÇÃO (mol/L) |
TIPO DE SOLUÇÃO |
pH |
A faixa de pH varia de 0 a 14. O logaritmo é uma função utilizada para reduzir a escala. De acordo com cada pH, há um tipo de solução:
0 1 2 3 4 5 6 |
7 |
8 9 10 11 12 13 14 |
Ácida |
Neutra |
Básica |
A determinação do pH hoje em dia é muito importante, como por exemplo em piscinas, num aquário, no solo, em um rio, no nosso organismo, etc. Pode determinar se uma solução é mais ácida ou mais básica.
Observe a tabela com diferentes valores de pH encontrados no nosso cotidiano:
SISTEMA |
pH a 25°C |
Água de bateria |
1,0 |
Suco gástrico |
1,6 |
Suco de limão |
2,2-2,4 |
Vinagre |
2,6-3,0 |
Suco de laranja |
3,0-4,0 |
Vinho |
3,5 |
Cerveja |
4,0 |
Chuva ácida |
4,0 |
Café |
5,0 |
Saliva |
6,5 |
Leite de vaca |
6,7 |
Água pura |
7 |
Água potável |
7,2 |
Sangue e lágrima |
7,4 |
Clara do ovo |
8,0 |
Água do mar |
8,0 |
Creme dental |
9,9 |
Sabonete |
10,0 |
Leite de magnésia |
10,5 |
Alvejante |
12,0 |
Soda cáustica “diabo-verde” |
14,0 |
Resumindo:
Água pura |
pH = 7 |
pOH = 7 |
Solução ácida |
pH < 7 |
pOH > 7 |
Solução básica |
pH > 7 |
pOH < 7 |
Exemplo:
- Calcule o pH de uma solução 0,1mol/L de NaOH.
![]()
![]()
![]()
![]()
![]()
pH + 1 = 14
pH = 14-1
pH = 13
Observe que a mesma concentração da solução de NaOH é a mesma concentração de íons OH-. Calcula-se primeiro o pOH e em seguida o pH.
- Calcule o pH de uma solução 0,002mol/L de HCl.
![]()
![]()
A concentração da solução é igual a concentração de íons H+.