Estequiometria comum / Estequiometria da fórmula
Os cálculos estequiométricos relacionam as grandezas e quantidades dos elementos químicos.
Utiliza-se muito o conceito de mol nestes cálculos. É muito importante saber transformar a unidade grama em mol. Pode-se usar a seguinte fórmula:
![]()
Onde:
n = número de mol (quantidade de matéria)
m = massa em gramas
MM = massa molar (g/mol)
Exemplo:
Quantas gramas existem em 2 mol de CO2?
![]()
![]()
![]()
![]()
Este cálculo pode ser feito também por regra de três:
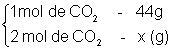
![]()
Para os cálculos com regra de três, sempre devemos colocar as unidade iguais uma embaixo da outra, como no exemplo acima.
Veja outros exemplos de cálculos estequiométricos envolvendo apenas a fórmula química:
- Quantos mols há em 90g de H2O?
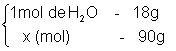
90 = 18. x
![]()
5 mol = x
- Quantas moléculas de água há em 3 mol de H2O?
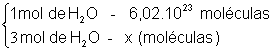
x = 3 . 6,02.1023
x = 18,06. 1023 ou 1,806.1024 moléculas
- Qual o volume ocupado por 4 mol do gás Cl2 nas CNTP?
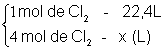
x = 4 x 22,4
x = 89,6L
- 4) Quantos mols existem em 89,6L do gás CO2 nas CNTP?
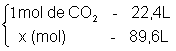
![]()
![]()
x = 4 mol































