Teoria de Bronsted-Lowry
Esta teoria é baseada nos estudos dos químicos Johannes Nicolaus Bronsted e Thomas Martin Lowry.
Juntos, eles definiram ácido e base na ausência de água, o que não é explicado pela Teoria de Arrhenius. A teoria é baseada em doar ou receber 1 próton.
Ácido de Bronsted-Lowry – é toda a espécie química que doa 1 próton.
Base de Bronsted-Lowry – é toda a espécie química que recebe 1 próton.
Exemplo:
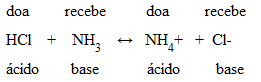
Neste caso, o HCl doa 1 próton para a amônia (NH3). Na reação reversa, o NH4+ é quem doa 1 próton para o íon Cl-.
Os ácidos e bases de Bronsted-Lowry formam pares conjugados. Sempre um ácido e uma base. O ácido da primeira reação e a base que formou. Assim:
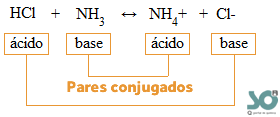
HCl e Cl- são pares conjugados.
O HCl é o ácido conjugado da sua base conjugada Cl-.
A NH3 e NH4+ são pares conjugados.
A NH3 é a base conjugada do seu ácido conjugado NH4+.