Alotropia
Alotropia é a propriedade que alguns elementos químicos têm de formar uma ou mais substâncias simples diferentes. São alótropos: carbono, oxigênio, fósforo e enxofre.
O carbono possui dois alótropos: o diamante e o grafite. Essas duas substâncias parecem não ter nada em comum. O grafite é um sólido macio e cinzento, com fraco brilho metálico, conduz bem a eletricidade e calor e tem densidade 2,25g/mL.
O diamante é sólido duro (o mais duro de todos), tem brilho adamantino, não conduz eletricidade nem calor e tem densidade 3,51g/mL. Mas as duas têm em comum a mesma composição química, expressa pela fórmula Cn, sendo n um número muito grande e indeterminado.
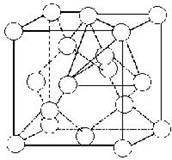
A principal diferença está no arranjo cristalino dos átomos de carbono. No grafite formam-se hexágonos. Cada átomo de carbono é ligado a apenas três outros átomos de carbono, em lâminas planas, fracamente atraídas umas pelas outras.
No diamante, cada átomo de carbono está ligado a quatro outros átomos também de carbono.



O oxigênio tem dois alótropos, formando duas substâncias simples: o gás oxigênio (O2) e o gás ozônio (O3).
O gás oxigênio é incolor e inodoro. Faz parte da atmosfera e é indispensável à vida dos seres aeróbicos. As plantas o devolvem para a atmosfera ao realizar a fotossíntese.
O gás ozônio é um gás azulado de cheiro forte e desagradável. Como agente bactericida, ele é usado na purificação da água nos chamados ozonizadores.
O ozônio está presente na estratosfera, a mais ou menos 20Km a 30Km da superfície da terrestre. Ele forma uma camada que absorve parte dos raios ultravioletas (UV) do Sol, impedindo que eles se tornem prejudiciais aos organismos vivos.

GÁS OXIGÊNIO GÁS OZÔNIO
O fósforo tem duas formas alotrópicas principais: o fósforo branco e o fósforo vermelho.
O fósforo branco (P4) é um sólido branco com aspecto igual ao da cera. É muito reativo, tem densidade igual a 1,82g/mL e se funde a uma temperatura de 44°C e ferve a 280°C. Se aquecermos a 300°C na ausência de ar ele se transforma em fósforo vermelho, que é mais estável (menos reativo).
O fósforo vermelho é um pó vermelho-escuro, amorfo (que não tem estrutura cristalina). Tem densidade igual a 2,38g/mL, ponto de fusão 590°C. Cada grão de pó desta substância é formado por milhões de moléculas P4, unidas umas às outras originando uma molécula gigante ( P∞).
O enxofre possui dois alótropos principais: o enxofre ortorrômbico ou simplesmente rômbico e o enxofre monocíclico. As duas formas são formadas por moléculas em forma de anel com oito átomos de enxofre (S8). A diferença está no arranjo molecular no espaço. Produzem cristais diferentes.
Os cristais rômbicos têm densidade 2,08g/mL e seu ponto de fusão é 112,8°C. Os monocíclicos têm densidade igual a 1,96g/mL e o ponto de fusão é 119,2°C.
Ambos alótropos do enxofre fervem a uma temperatura de 445°C. É um pó amarelo, inodoro, insolúvel em água e muito solúvel em sulfeto de carbono (CS2).
































