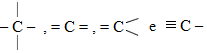Ligações intramoleculares (continuação)
Ligação covalente
A ligação covalente é realizada de acordo com a diferença de eletronegatividade. Geralmente, ocorre entre um não metal e não metal, hidrogênio e não metal e hidrogênio com hidrogênio.
Esta ligação é caracterizada pelo compartilhamento de elétrons entre os átomos. O hidrogênio possui um elétron na sua camada de valência. Para ficar idêntico ao gás nobre hélio com 2 elétrons na última camada. Ele precisa de mais um elétron. Então, 2 átomos de hidrogênio compartilham seus elétrons ficando estáveis:
Ex. H (Z = 1) K = 1
H – H → H2
O traço representa o par de elétrons compartilhados.
Nessa situação, tudo se passa como se cada átomo tivesse 2 elétrons em sua eletrosfera. Os elétrons pertencem ao mesmo tempo aos dois átomos, ou seja, os dois átomos compartilham os 2 elétrons. A menor porção de uma substância resultante de ligação covalente é chamada de molécula.
Então, o H2 é uma molécula ou um composto molecular. Um composto é considerado composto molecular ou molécula quando possui apenas ligações covalentes. Observe a ligação covalente entre dois átomos de cloro:

Fórmula de Lewis ou Fórmula Eletrônica
Cl – Cl
Fórmula Estrutural
Cl 2
Fórmula Molecular
Conforme o número de elétrons que os átomos compartilham, eles podem ser mono, bi, tri ou tetravalentes.
A ligação covalente pode ocorrer também entre átomos de diferentes elementos, por exemplo, a água.

Fórmula de Lewis
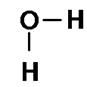
Fórmula Estrutural
H2O
Fórmula Molecular
A água, no exemplo, faz três ligações covalentes, formando a molécula H2O. O oxigênio tem 6é na última camada e precisa de 2é para ficar estável. O hidrogênio tem 1 é e precisa de mais 1é para se estabilizar. Sobram ainda dois pares de elétrons sobre o átomo de oxigênio.
A ligação covalente pode ser representada de várias formas. As fórmulas em que aparecem indicados pelos sinais . ou x são chamadas de fórmula de Lewis ou fórmula eletrônica.
Quando os pares de elétrons são representados por traços (-) chamamos de fórmula estrutural plana, mostrando o número de ligações e quais os átomos estão ligados. A fórmula molecular é a mais simplificada, mostrando apenas quais e quantos átomos têm na molécula. Veja o modelo:
H . . H (fórmula de Lewis ou eletrônica)
H – H (fórmula estrutural plana)
H2 (fórmula molecular)
Observe a tabela de alguns elementos com sua valência (covalência) e a sua representação.
ELEMENTO |
COMPARTILHA |
VALÊNCIA |
REPRESENTAÇÃO |
HIDROGÊNIO |
1é |
1 |
H – |
CLORO |
1é |
1 |
Cl – |
OXIGÊNIO |
2é |
2 |
– O – e O = |
ENXOFRE |
2é |
2 |
– S– e S = |
NITROGÊNIO |
3é |
3 |
|
CARBONO |
4é |
4 |
|
Algumas regras para montar a ligação covalente:
- colocar o elemento central no meio;
- colocar o elemento mais eletronegativo ao redor do átomo central;
- colocar o hidrogênio ligado ao oxigênio.
Propriedades da ligação covalente:
- formam moléculas;
- em geral, são solúveis em solventes apolares;
- possuem baixo PF e PE;
- em geral, não conduzem eletricidade, exceto os ácidos.
A ligação covalente normal é a união entre átomos estabelecida por pares de elétrons, de modo que cada par seja formado por um elétron de cada um dos átomos. Exemplo:
![]()
Este tipo de ligação aparece com muita frequência em substâncias compostas.
A ligação covalente dativa é a ligação onde o par de elétrons é cedido por apenas um dos átomos da ligação.
Na ligação do dióxido de enxofre (SO2) ocorre assim:
![]()
Nesta ligação, o enxofre cede o seu par de elétrons para o átomo de oxigênio. Não há compartilhamento.
A ligação covalente dativa é representada por uma seta, que vai do átomo doador até o átomo que recebeu o par de elétrons. Assim como a ligação covalente normal, a dativa também continua com o octeto ao redor de cada átomo, mantendo então a estabilidade.
Outro exemplo é o trióxido de enxofre (SO3):
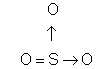
Outro exemplo é o monóxido de carbono (CO), que apresenta duas ligações covalentes normais e uma covalente dativa entre o carbono e o oxigênio.
![]()
É importante lembrar que substâncias formadas apenas por ligações covalentes, normal ou dativa, são chamadas de moléculas ou composto molecular.
Uma substância pode ter ligações iônicas e também covalentes. Se tiver pelo menos uma ligação iônica, então será considerada um composto iônico.
Se a substância é formada apenas por ligações iônicas, então chamamos de agregado iônico. Num composto iônico, não há moléculas.