Reações de oxidação
As reações de oxidação das substâncias orgânicas devem ser catalisadas por um agente oxidante.
São simbolizados por [O] e podem ser o permanganato de potássio (KMnO4), dicromato de potássio (K2Cr2O7) ou o tetraóxido de ósmio (OsO4).
As reações mais importantes de oxidação são as seguintes:
- oxidação energética dos alcenos
- oxidação de álcool primário
- oxidação de álcool secundário
Oxidação energética dos alcenos
Esta oxidação ocorre nos alcenos em contato com um agente oxidante em solução aquosa, concentrada e ácida (geralmente em ácido sulfúrico).
Nesta reação, podemos obter vários produtos, dependendo do tipo da posição da ligação dupla. Observe:
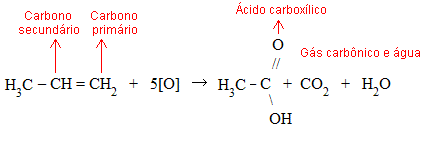
- carbono primário produz gás carbônico e água
- carbono secundário produz ácido carboxílico
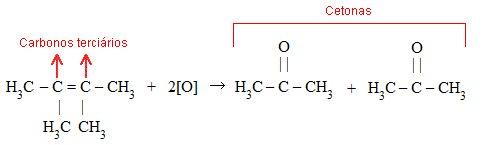
- carbono terciário produz cetona
Esta reação serve como teste de insaturação de alceno, ou seja, para identificar que tipo de alceno se tem. Acompanhe o exemplo:
Veja outro exemplo envolvendo carbonos terciários:
Oxidação de álcoois primários
Os álcoois primários se oxidam com oxidantes energéticos, como o permanganato de potássio e dicromato de potássio, em meio sulfúrico.
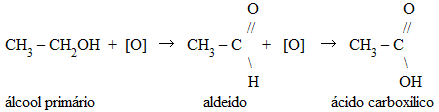
O produto desta oxidação é aldeído. Com mais quantidade de agente oxidante, obtemos um ácido carboxílico.
Esta reação explica porque o vinho fica com gosto de vinagre quando o deixamos muito tempo em contato com o ar (oxigênio). O álcool sofre uma oxidação e tranforma-se em vinagre, que é um ácido carboxílico.
Exemplo:
Oxidação de álcoois secundários
Os álcoois secundários têm como produto as cetonas. Exemplo:
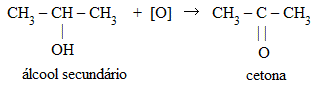
Observação: Não existe oxidação de álcool terciário.































