Introdução à Química - Constituição da matéria
Átomo
Toda matéria é formada por partículas muito pequenas. Essas partículas chamamos de átomos.
ÁTOMO – É uma partícula indivisível.
Há cerca de 2,5 mil anos, o filósofo grego Demócrito disse que, se dividirmos a matéria em pedacinhos cada vez menores, chegaremos a grãozinhos indivisíveis, que são os átomos (a = não e tomo = parte). Em 1897, o físico inglês Joseph Thompson (1856-1940) descobriu que os átomos eram divisíveis: lá dentro havia o elétron, partícula com carga elétrica negativa.
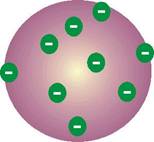
Em 1911, o neozelandês Ernest Rutherford (1871-1937) mostrou que os átomos tinham uma região central compacta chamada núcleo e que lá dentro encontravam-se os prótons, partículas com carga positiva.
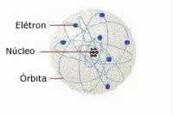
Fonte: http://static.hsw.com.br/gif/atom-rutherford.jpg
Em 1932, o físico inglês James Chadwick (1891-1974) descobriu o nêutron, partícula neutra, companheira do próton no núcleo atômico.
No início dos anos 60, os cientistas já achavam que prótons e nêutrons eram formados por partículas ainda menores. Murray Gell-Mann, nascido em 1929 sugere a existência dos quarks, que seriam essas partículas menores. Os quarks são mantidos juntos por outras partículas denominadas gluons.
Acreditava-se, na Antiguidade, que os átomos eram indivisíveis e maciços. No século XX ficou provado que os átomos são formados por outras partículas. São três partículas fundamentais: elétrons, prótons e nêutrons.
O átomo se divide em duas partes: o núcleo e a eletrosfera. Os prótons e nêutrons ficam no núcleo do átomo e os elétrons ficam na eletrosfera.
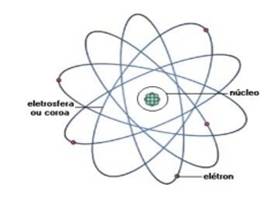
Fonte: http://www.infoescola.com/Modules/Articles/Images/full-1-3d6aba4843.jpg
Essas partículas são caracterizadas pelas suas cargas elétricas. O elétron tem carga -1 e massa desprezível (sendo aproximadamente 1/1836 a massa do próton). A massa do próton seria então igual a 1 e a carga +1. O nêutron não possui carga elétrica e sua massa é igual a do próton.
Observe a tabela entre as relações de massa das partículas fundamentais do átomo. Adota-se como padrão o próton com massa igual a 1:
| PARTÍCULA | MASSA | CARGA ELÉTRICA |
p |
1 |
+1 |
n |
1 |
0 |
é |
1/1836 |
-1 |
Note que a massa do elétron é 1.836 vezes menor que a do próton, por isso desconsidera-se a sua massa.
Tamanho do Átomo
O tamanho do átomo é medido em angstrons (Å).
1 angstron = 10-10metros
O diâmetro médio do núcleo de um átomo fica entre 10-4 Å e 10-5 Å e o da eletrosfera é de 1Å.
A eletrosfera de um átomo é entre 10000 e 100000 vezes maior que o seu núcleo. Essa diferença de tamanho nos leva a admitir que o átomo é quase feito de espaço vazio. Em termos práticos, se o núcleo tivesse o tamanho de uma bola de tênis, o primeiro elétron estaria a uma distância de 1 km.