Lei de Proust
"Uma determinada substância composta é formada por substâncias mais simples, unidas sempre na mesma proporção em massa".
O químico francês Joseph Louis Proust observou que, em uma reação química, a relação entre as massas das substâncias participantes é sempre constante. A Lei de Proust ou a Lei das proporções definidas diz que dois ou mais elementos, ao se combinarem para formar substâncias, conservam entre si proporções definidas.
Observe: A massa de uma molécula de água é 18g e é resultado da soma das massas atômicas do hidrogênio e do oxigênio.

H2 – massa atômica = 1 → 2 x 1 = 2g
O – massa atômica = 16 → 1 x 16 = 16g
Então, 18g de água tem sempre 16g de oxigênio e 2g de hidrogênio. A molécula água esta na proporção 1:8.
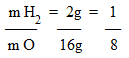
As Leis de Lavoisier e de Proust são chamadas de Leis Ponderais porque estão relacionadas à massa dos elementos químicos nas reações químicas.






























