Fatores que alteram a velocidade das reações químicas (continuação)
Catalisador
Catalisador é uma substância química que não participa da reação química. Diminui a energia de ativação e aumenta a velocidade da reação.
O catalisador acelera a reação, mas não altera a composição química dos reagentes e produtos envolvidos. A quantidade de substância produzida na reação não se altera com o uso de catalisadores.
Se a reação for reversível, a reação inversa também será acelerada, pois sua energia de ativação também terá um valor menor. O catalisador não altera a variação de entalpia.
![]()
Gráficos com e sem catalisadores:
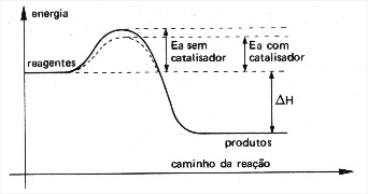
http://clientespeedy.klickeducacao.com.br/2006/arq_img_upload/paginas/558/cineticanew2.jpg
Catálise é o aumento de velocidade da reação, provocado pelo catalisador. A palavra catálise, do grego katálysis, foi introduzida, em 1835, por Berzeliu.
No nosso organismo, existem muitos catalisadores, que são chamados de enzimas. A saliva e o suco gástrico (que contém ácido clorídrico) são exemplos de enzimas que aumentam a velocidade da reação, no caso, a digestão.
Nas indústrias químicas, principalmente a petroquímica, os catalisadores são muito utilizados para acelerar as reações, deixando o processo mais barato.
Uma forma de ver a ação dos catalisadores é adicionando açúcar ao refrigerante. Os refrigerenates carbonatados contém dióxido de carbono (gás carbônico) e pode ser eliminado mais facilmente com adição de açúcar. A reação de eliminação do gás acontece com mais velocidade e percebe-se a formação de bolhas do gás deixando a solução.
Na equação química, coloca-se o catalisador em cima da seta que representa a reação química. Em função dos estados físicos dos reagentes e produtos, a catálise pode ser homogênea ou heterogênea.
- catálise homogênea: quando reagentes e catalisador estão no mesmo estado físico, formando um sistema monofásico.

- catálise heterogênea: quando reagentes e catalisador não estão no mesmo estado físico, formando um sistema heterogêneo.
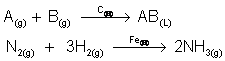
Não existe um tipo ideal de catalisador. Para cada reação química existe um tipo diferente de catalisador. Os catalisadors mais comuns são:
- metais - principalmente os de transição: Co, Ni, Pt, Pd
- ácidos - que catalisam muitas reações orgânicas: H2SO4
- óxidos metálicos – Al2O3, Fe2O3
- bases - NaOH
- enzimas – produzidas pelos organismos vivos: lipase, suco gástrico.
Inibidores
São substâncias, que ao contrário dos catalisadores, aumentam a energia de ativação e, como consequência, diminuem a velocidade da reação química.
O inibidor pode ser chamado também de veneno de catalisador ou anticatalisador. Antigamente, era chamado de catalisador negativo.
![]()
Velocidade instantânea
Nas reações químicas, a velocidade a cada instante é diferente da velocidade média. As velocidades instantâneas nunca são as mesmas, possuindo valores diferentes durante a reação.
Se os intervalos de tempo utilizados nas medidas da velocidade média forem ficando cada vez menores, a velocidade média tenderá a assumir valores cada vez mais próximos da velocidade em um certo instante.
Velocidade instantânea é o valor para o qual tende a velocidade média quando os intervalos de tempo vão se tornando cada vez menores.
Pode ser calculada de acordo com a “Lei Cinética ou Equação de Velocidade”, proposta por Guldberg e Waage.































