Lei de Guldberg e Waage
A Lei da Velocidade ou Lei de Guldberg-Waage foi proposta em 1867 pelos cientistas norugueses Cato Maximilian Guldberg (1836-1902) e Peter Waage (1833-1900). Foi enunciada da seguinte forma:
"A velocidade de uma reação é diretamente proporcional ao produto das concentrações molares dos reagentes, para cada temperatura, elevada a expoentes experimentalmente determinados."
Os expoentes que constam na lei irão determinar a ordem da reação. Para uma reação genérica, temos:
![]()
![]()
Onde:
V = velocidade da reação
K = constante de velocidade
[A] = concentração molar de A
[B] = concentração molar de B
X e Y = expoentes experimentalmente determinados
Em uma reação elementar, onde ocorre em uma única etapa, o expoente é o coeficiente dos reagentes.
![]()
![]()
Exemplo:
![]()
![]()
Alguns processos químicos oorrem em várias etapas. As reações globais são as que ocorrem em mais de uma etapa. A velocidade desta reação depende da velocidade das etapas participantes. Quando isto acontecer, determina-se a velocidade da reação através da etapa lenta.
É fácil entender porque utiliza-se a etapa lenta para determinar a velocidade da reação. Imagine por exemplo uma viagem de ônibus entre as cidades de São Paulo e Rio de Janeiro.
Aparentemente, temos a impressão que a viagem vai acontecer em uma única etapa (sair de São Paulo e chagar ao Rio). Mas na prática, há três etapas. A primeira etapa é chegar até a rodoviária (10 minutos), a segunda pegar o ônibus, mais 5 horas (300 minutos) e por último, já no Rio de Janeiro, pegar um ônibus até o seu destino (5 minutos).
Como a segunda etapa gastou mais tempo, arredondamos a viagem para 5 horas. Com as reações químicas é mais ou menos assim que acontece. Exemplo:
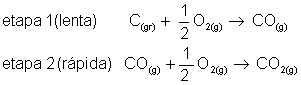
_____________________________________
![]()
Velocidade da reação: ![]()
Ordem da reação e molecularidade
A ordem de uma reação química só pode ser determinada experimentalmente. A molecularidade representa o número mínimo de moléculas ou íons reagentes necessários para que ocorram colisões e a reação possa se processar em uma única etapa (elementar).
Os expoentes que estão na lei da velocidade podem determinar a ordem da reação.
![]()
![]()
Onde:

Exemplo:
![]()
![]()
Lei da velocidade:
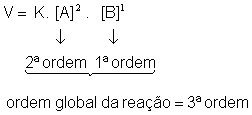
Molecularidade: 3 - trimolecular
A ordem da reação pode indicar o que acontece com a velocidade da reação quando é alterada a concentração dos reagentes.
Ordem |
O que acontesse com a concentração |
1ª |
Igual |
2ª |
Duplica (quadrado) |
3ª |
Ao cubo |
Veja o exemplo. Seja a equação química:
![]()
Responda:
a) equação da velocidade:
![]()
b) ordem da reação:
2ª ordem
c) o que acontece com a velocidade quando a concentração de NO2 é dobrada?
2² = 4 (a velocidade aumenta 4 vezes).
d) o que acontece com a velocidade quando a concentração do CO é dobrada?
Não acontece nada porque a concentração do CO não altera nada. A sua ordem é zero.






























