Equilíbrio químico (continuação)
Constante de equilíbrio (Kc)
Observe a seguinte reação química. Sendo a reação direta 1 e a reação inversa 2.
![]()
De acordo com a lei cinética ou lei da velocidade:
![]()
No instante do equilíbrio:
![]()
Isolando K :
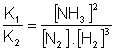
A divisão de duas constantes, em matemática, origina uma terceira constante:
![]()
KC = constante de equilíbrio em função das concentrações
Então: 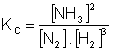
Conhecendo-se o valor das concentrações das substâncias no momento do equilíquio, pode-se calcular a constante KC. A constante de equilíbrio não possui unidade, é adimensional.
A constante de equilíbrio KC é dada pela razão (divisão) das concentrações dos produtos pela concentração dos reagentes da reação direta, elevados a expoentes iguais aos seus coeficientes estequiométricos da reação química.
![]()
Esta fórmula representa a Lei da ação das massas ou a Lei de Guldberg-Waage.































