Propriedades das constantes
É possível, a partir das constantes de equilíbrio da reação direta, obter a constante de equilíbrio da reação inversa. Também podemos multiplicar as constantes.
Reação Inversa
Seja a reação química:
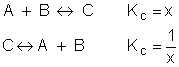
Exemplo:
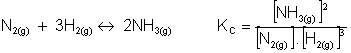
A sua reação inversa será:
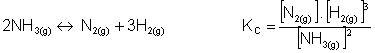
Adição de uma reação
Se duas reações são adicionadas, o novo KC será o produto das constantes originais.
![]()
Multiplicação de uma reação
Se duas reações são multiplicadas por um determinado número, a sua nova KC será elevada à este valor.
Veja o modelo:
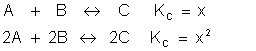
Divisão de uma reação
Se duas reações são divididas por um determinada número, a sua nova KC será a sua raíz.
Veja o modelo:
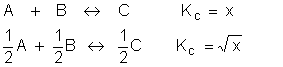
Reação com substância pura líquida ou sólida
As substâncias puras líquidas e sólidas possuem concentração constante, onde o valor está incorporado ao da constante KC. Por este motivo, nas expressões de constante de equilíbrio, não se coloca as suas concentrações no cálculo da KC.
Exemplo:
![]()
![]()
Constante de equilíbrio em função das pressões parciais (Kp)
Se uma determinada reação química apresentar substâncias no estado gasoso, a constante de equilíbrio pode ser dada em função das suas pressões parciais.
Exemplo:
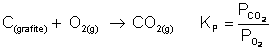
Para o cálculo da pressão parcial, utiliza-se o conceito de fração molar (x). Calcula-se a fração molar e em seguida, a pressão parcial do gás. Exemplo:
3 mols de PCl5(g) são colocados em um recipiente, atingindo o seguinte equilíbrio:
![]()
No momento do equilíbrio, 60% do reagente sofre dissociação. Sabendo que a pressão total do sistema é 4,8atm, calcule o valor de KP:
1°) calcular a quantidade de mols, sendo 60%:
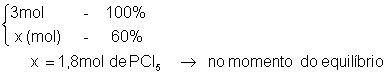
2°) montar a tabela do equilíbrio químico:
PCl5 |
PCl3 |
Cl2 |
|
início |
3 |
- |
- |
reagiu/formou |
1,8 |
1,8 |
1,8 |
equilíbrio |
3 -1,8=1,2 |
1,8 |
1,8 |
3°) calcular as frações molares:
![]()
![]()
![]()
nT = número total de mols
4°) calcular a pressão parcial dos gases:
![]()
![]()
![]()
![]()
O somatório das pressões parciais deve ser igual à pressão total:
![]()
Ou seja: ![]()
5°) calcular a KP :
![]()































