Geometria molecular
A geometria molecular explica como estão dispostos os átomos dentro da molécula.
Os átomos tendem a ficar numa posição mais espaçada e esparramada possível. Assim, conseguem adquirir a estabilidade.
As geometrias moleculares são: linear, angular, trigonal planar, piramidal, tetraédrica, octaédrica, forma de T, bipirâmide trigonal, gangorra ou tetraédrica distorcida, quadrado planar e pirâmide de base quadrática.
Veja as principais geometrias moleculares a seguir.
Linear
Exemplo:
![]()
Para moléculas diatômicas (com dois átomos)
Polar – átomos diferentes: HCl H – Cl
Apolar – átomos iguais: H2 H – H
Para moléculas triatômicas (com três átomos)
Sem sobra de elétrons do elemento central. Apolares.
Formam um ângulo de 180°.
CS2 S – C – S
Angular
Para moléculas triatômicas, com sobra de elétrons. Polares.
Formam um ângulo de 109°28´.

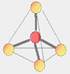
Trigonal planar
Para moléculas tetratômicas, sem sobra de elétrons. Apolares.
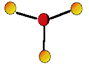
Piramidal
Para moléculas tetratômicas, com sobra de um par de elétrons. Polares.

Tetraédrica
Para moléculas pentatômicas com átomo central. Apolares.