Modelo de Rutherford
Em 1911, o neozelandês Ernest Rutherford realizou uma importante experiência.

Ele pegou um pedaço do metal polônio (Po), que emite partículas alfa (α), e colocou em uma caixa de chumbo com um pequeno orifício.
As partículas alfa atravessavam outras placas de chumbo através de orifícios no seu centro. Depois atravessavam um lâmina muito fina (10-4mm) de ouro (Au).
Rutherford adaptou um anteparo móvel com sulfeto de zinco (fluorescente) para registrar o caminho percorrido pelas partículas.
O físico observou que a maioria das partículas alfa atravessava a lâmina de ouro e apenas algumas desviavam, ou até mesmo retrocediam.
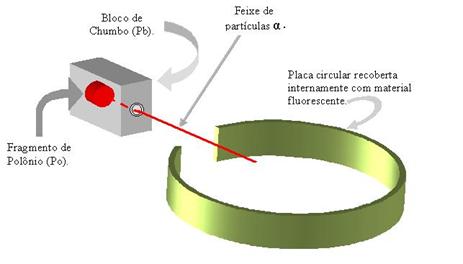
A partir destes resultados, concluiu que o átomo não era uma esfera positiva com elétrons mergulhados nesta esfera. Concluiu que:
- o átomo é um enorme vazio;
- o átomo tem um núcleo muito pequeno;
- o átomo tem núcleo positivo (+), já que partículas alfa desviavam algumas vezes;
- os elétrons estão ao redor do núcleo (na eletrosfera) para equilibrar as cargas positivas.
O modelo atômico de Rutherford sugeriu então um átomo com órbitas circulares dos elétrons em volta do núcleo. Comparou o átomo com o Sistema Solar, onde os elétrons seriam os planetas e o núcleo seria o Sol.
Hoje, sabe-se que o átomo é 10.000 a 100.000 vezes maior que seu núcleo. Numa escala macroscópica, pode-se comparar um átomo com um estádio de futebol.
Se o átomo fosse o estádio do Maracanã, o seu núcleo seria uma formiga no centro do campo. Então o átomo é enorme em relação ao seu núcleo.
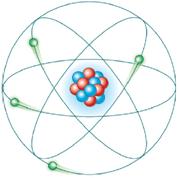
Porém, o átomo de Rutherford tem algumas falhas. Se o núcleo atômico é formado por partículas positivas, por que essas partículas não se repelem e o núcleo não desmorona?
Se as partículas são de cargas opostas, por que elas não se atraem? Os elétrons iriam perder energia gradualmente percorrendo uma espiral em direção ao núcleo e, à medida que isso acontecesse, emitiriam energia na forma de luz.
Mas como os elétrons ficam em movimento ao redor do núcleo sem que os átomos entrem em colapso?
Estas questões foram respondidas em 1932 por James Chadwick. Ele observou que o núcleo do berílio (Be) radioativo emitia partículas sem carga elétrica e com massa igual à dos prótons (+). Chamou esta partícula de nêutrons.
Surgia então, a terceira partícula subatômica. Agora, sabemos que no núcleo do átomo há prótons e nêutrons e na eletrosfera há elétrons.
Então estabeleceu-se esta relação:
PARTÍCULA |
MASSA |
CARGA ELÉTRICA |
p |
1 |
+1 |
n |
1 |
0 |
é |
1/1836 |
-1 |
Na tabela acima, pode-se verificar que o elétron é 1.836 vezes menor que a massa de um próton.































