Modelo de Bohr
O modelo do físico dinamarquês Niels Bohr tentava dar continuidade ao trabalho feito por Rutherford.

Para explicar os erros do modelo anterior, Bohr sugeriu que o átomo possui energia quantizada. Cada elétron só pode ter determinada quantidade de energia, por isso ele é quantizada.
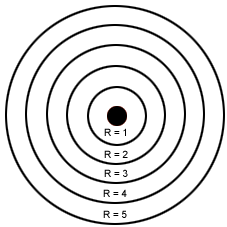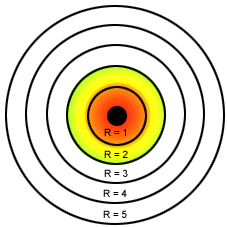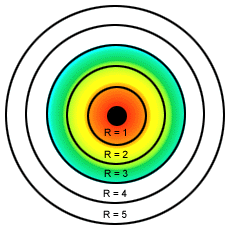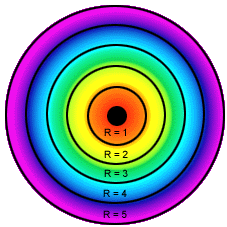
O modelo de Bohr representa os níveis de energia. Cada elétron possui a sua energia. É comparado às orbitas dos planetas do Sistema Solar, onde cada elétron possui a sua própria órbita e com quantidades de energia já determinadas.
As leis da física clássica não se enquadram neste modelo. Quando um elétron salta de um nível menor para um nível mais elevado, ele absorve energia, e quando ele retorna para um nível menor, o elétron emite uma radiação em forma de luz.
Bohr organizou os elétrons em camadas ou níveis de energia. Cada camada possui um nome e deve ter um número máximo de elétrons.
Existem sete camadas ou níveis de energia ao redor do núcleo: K, L, M, N, O, P, Q.
Observe a tabela que mostra o nome das camadas, o seu número quântico e o número máximo de elétrons em cada.
|
n° quântico |
nº máximo de é |
K |
1 |
2 |
L |
2 |
8 |
M |
3 |
18 |
N |
4 |
32 |
O |
5 |
32 |
P |
6 |
18 |
Q |
7 |
2 |