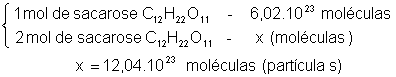Propriedades coligativas
O que acontece com o ponto de ebulição da água se adicionarmos sal de cozinha? Por que a água ferve mais rápido em locais de elevada altitude? Por que se adiciona sal nas estradas no inverno?
Essas perguntas estão relacionadas às propriedades que comparam o comportamento das soluções com o seu solvente puro.
As propriedades coligativas das soluções são aquelas que se relacionam diretamente com o número de partículas de soluto que se encontram dispersas (dissolvidas) em um determinado solvente.
Dependem do número de partículas dispersas na solução, independente da natureza dessa partícula. São as alterações que os solutos causam ao solvente.
Durante o estudo das propriedades coligativas, sempre é necessário comparar o comportamento da solução com o respectivo solvente puro.


Solvente puro água e soluto sal de cozinha. Quando misturados, provocam alteração nas propriedades físicas do solvente, neste caso o aumento do ponto de fusão (P.F).
Um exemplo desta comparação é o ponto de ebulição da água. Verifique que ao se aquecer água pura, ao nível do mar, a temperatura de ebulição da água (solvente puro) é igual a 100°C. No entanto, quando se aquece uma solução aquosa de NaCl, percebe-se que o ponto de ebulição da água sofre um aumento.
A elevação do ponto de ebulição da água na solução sempre irá produzir efeitos em algumas propriedades físicas de um solvente, que são:
- diminuição da pressão de vapor
- aumento do ponto de ebulição
- diminuição do ponto de congelamento
- aumento da pressão osmótica
Estes efeitos são conhecidos como efeitos coligativos, que dependem exclusivamente da concentração (quantidade) de partículas que se encontram dispersas num solvente.
Os efeitos coligativos definem as quatro propriedades coligativas, que são as seguintes:
- tonoscopia
- ebulioscopia
- crioscopia
- osmometria
Partículas dissolvidas
Antes de iniciar o estudo das propriedades coligativas, é importante saber calcular o número de partículas que ficam dissolvidas nas soluções. Serão encontradas dois tipos de partículas, as moleculares e as iônicas.
Soluções moleculares
São as soluções que possuem moléculas como partículas dispersas. O número de partículas (moléculas dissolvidas) é igual ao número de partículas que se encontram em solução. Exemplos de partículas moleculares:
- glicose – C6H12O6
- sacarose – C12H22O11
- ureia – CO(NH2)2
O cálculo das soluções moleculares é feito a partir do conceito de mol, levando em conta o número de Avogadro.
1 mol de partículas = número de Avogadro = 6,02.1023 partículas
Exemplo: calcule o número de partículas de sacarose contidas em 1L de solução 2mol/L: