Propriedades coligativas (continuação)
Soluções iônicas
São as soluções que possuem íons como partículas dispersas. Em uma solução iônica, nem todos os íons estão dissociados, ou seja, nem todos os íons estão dissolvidos na solução.
Para realizar o cálculo das partículas dissociadas em soluções iônicas, é necessário levar em consideração o grau de dissociação ou ionização (![]() ) da substância que está dissolvida.
) da substância que está dissolvida.
As partículas iônicas podem ser ácidos, bases ou sais.
Se o ácido sulfúrico apresenta um grau de ionização igual a 61%, isto quer dizer que 61% dos seus íons se dissociam e que 39% não se dissociam.
Exemplo: considere que uma solução de Al2(SO4)3 é dissolvida em água e que sua dissociação é 100%
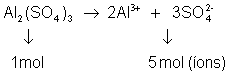
Se tivesse grau de dissociação 60%:
Em 1 mol de partículas dissolvidas:
- 0,6mol de partículas ionizadas
- 0,4mol de partículas não-ionizadas
Fórmula para as partículas ionizadas: ![]()
Fórmula para as partículas não ionizadas: ![]()
Onde:
n1 = número de mol do soluto
![]() grau de dissociação (%)
grau de dissociação (%)
n° íons = número de íons na solução
Veja como o cálculo pode ser feito:
Calcule o número de partículas dissolvidas em uma solução que contem 33g de H3PO2 com ![]() :
:
1°) montar a reação de dissociação:
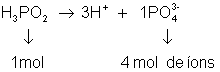
2°) calcular a massa molar:
MM = massa molar (H3PO2) = 66g/mol
3°) Calcular o número de mol:
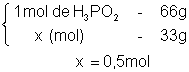
4°) Calcular o número de partículas ionizadas e não ionizadas, em seguida somar:
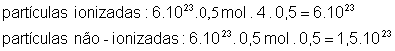
![]()
Observe que o grau de ionização na fórmula foi dividido por 100.