Pressão de vapor (Pv)
Em qualquer temperatura, as moléculas de qualquer líquido estão sempre em movimento, algumas com velocidades maiores que as outras. Por isso, conseguem escapar do liquído, passando para a atmosfera.
É o que acontece, por exemplo, com a roupa secando no varal ou uma poça d'água que vai desaparecendo. A velocidade de evaporação do líquido é igual à velocidade de condensação de seus vapores.
Dizemos então que há um equilíbrio dinâmico entre o líquido e seus vapores. Os vapores do líquido chegaram ao estado de vapores saturados e foi alcançada a pressão máxima de vapor do líquido.
Pressão máxima de vapor (Pv) é a pressão exercida por seus vapores quando estes estão em equilíbrio dinâmico com o líquido. Pode-se dizer também que é a pressão exercida pelas moléculas do solvente líquido contra a a sua superfície para passar para o estado de vapor.
Quanto maior a Pv, mais volátil é o líquido. Ou seja, quanto mais pressão o líquido faz contra a sua superfície, mais este líquido passará para o estado de vapor, evaporando mais rápido. Alguns fatores influenciam na pressão de vapor, como:
- temperatura
- natureza do líquido
Temperatura
Quando se aquece um líquido, a quantidade de vapor tende a aumentar conforme o tempo, o que fará com que a pressão de vapor também aumente.
O aumento da temperatura ocasiona a agitação das moléculas. O líquido evapora mais intensamente e causa maior pressão de vapor. Veja o caso da água pura:
T (°C) |
Pv (mmHg) |
0 |
4,6 |
10 |
9,2 |
20 |
17,5 |
30 |
31,8 |
40 |
55,3 |
50 |
92,5 |
60 |
149,4 |
70 |
233,7 |
80 |
355,1 |
90 |
525,8 |
100 |
760,0 |
110 |
1.074,6 |
120 |
1.489,1 |
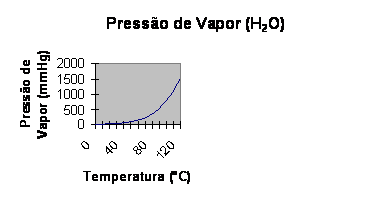
Quanto maior Pv, mais volátil (mais evapora)
Natureza do líquido
Considere um frasco que contém água e outro contendo álcool, ambos no estado líquido e com mesmo volume e temperatura. Nos dois frascos há um manômetro para medir a pressão de vapor das substâncias.
Após algum tempo, a pressão indicada pelo álcool foi maior do que a pressão indicada para a água, porque no frasco do álcool houve a formação de uma quantidade maior de vapores, já que o álcool é uma substância mais volátil.
Conclui-se que a pressão de vapor de uma substância depende apenas de sua natureza química e não da quantidade.
Líquidos mais voláteis que a água, como éter comum, álcool etílico e acetona, evaporam mais intensamente e possuem maior pressão de vapor.
Quanto menor a temperatura, mais evapora, maior Pv
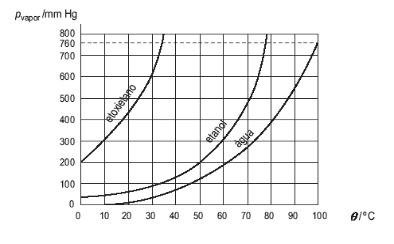
Fonte: esds.edu.pt/antiga/afa/quimica/Imagens/I_17.png































